Pengertian Alkana, Tata Nama, Sifat, Kegunaan dan Contoh Alkana Terlengkap – Senyawa hidrokarbon adalah senyawa yang mengandung unsur hidrogen dan karbon. Atom karbon selain dapat membentuk rantai karbon, juga bisa membentuk ikatan kovalen tunggal, rangkap dua, dan rangkap tiga. Sehingga senyawa hidrokarbon dapat dibagi menjadi 2 yaitu senyawa hidrokarbon jenuh dan senyawa hidrokarbon tak jenuh. Senyawa hidrokarbon jenuh adalah senyawa hidrokarbon yang memiliki ikatan rantai karbon jenuh (tunggal), contohnya senyawa alkana. Sedangkan senyawa hidrokarbon tak jenuh adalah senyawa hidrokarbon yang terdapat ikatan kovalen rangkap 2 atau 3 pada rantai karbonnya, Contohnya seperti alkena dan alkuna. Kali ini kita akan membahas tentang senyawa hidrokarbon Alkana.
Pengertian Alkana
Alkana adalah senyawa hidrokarbon yang memiliki ikatan rantai karbon tunggal. Rumus umum alkana yaitu CnH2n+2. Dari metana ke etana memiliki perbedaan –CH2–, begitu seterusnya. Deret senyawa karbon dengan gugus fungsi sama dengan selisih sama yakni –CH2– disebut deret homolog.
Alkana atau parafin adalah senyawa kimia hidrokarbon jenuh asiklis. Alkana juga termasuk senyawa alifatik atau dengan kata lain, Alkana adalah sebuah rantai karbon panjang dengan ikatan tunggal.
Tata Nama Senyawa Alkana Menurut IUPAC
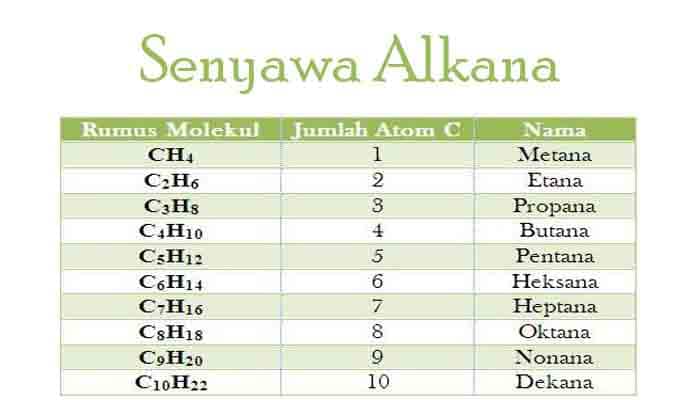
Perhatikan Deret Homolog Alkana!
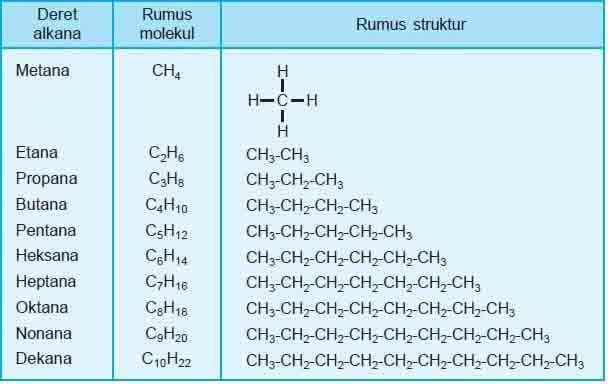
Penamaan alkana mengikuti sistem IUPAC, yaitu sistem tata nama yang didasarkan pada gagasan bahwa struktur suatu senyawa organik dapat digunakan untuk menurunkan namanya dan sebaliknya, bahwa suatu struktur yang unik dapat digambar untuk tiap nama.
Dasar sistem IUPAC yaitu alkana rantai lurus.
A. Alkana rantai lurus (tidak bercabang)
Alkana rantai lurus diberi nama sesuai dengan jumlah atom karbonnya sebagaimana tercantum dalam tabel di atas. Terkadang ditambahkan normal (n) di depan nama alkana.
Contoh:
- CH3-CH2-CH2-CH3 n-butana
- CH3-CH2-CH2-CH2-CH3 n-pentana
B. Alkana siklis (rantai tertutup)
Alkana rantai siklis (tertutup) diberi nama menurut banyaknya atom karbon dalam cincin, dengan penambahan awalan siklo-.
C. Alkana bercabang (memiliki rantai samping)
Senyawa alkana terkadang berikatan dengan unsur lain pada salah satu atau beberapa atom karbonnya. Unsur lain dalam rantai alkana tersebut biasa dinamakan substituen. Jenis substituen alkana yang sering dijumpai yaitu gugus alkil. Gugus alkil adalah alkana yang kehilangan 1 atom H. Penamaannya sama dengan alkana, hanya akhirannya diubah menjadi -il. Rumus umumnya CnH2n+2. Berikut tabel deret gugus alkil.
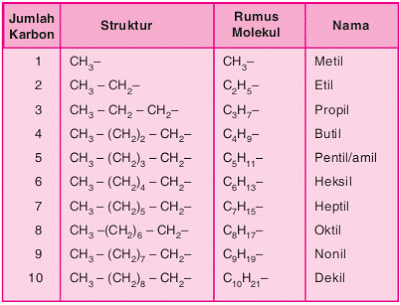
Jika alkana memiliki rantai bercabang maka penamaannya mengikuti aturan sebagai berikut.
- Rantai terpanjang merupakan rantai utama.
- Rantai utama diberi nomor mulai dari ujung rantai yang memiliki substituen.
- Urutan penulisan nama : nomor cabang, nama cabang, nama alkana rantai utama.
- Jika terdapat gugus metil pada atom C nomor 2, nama alkana diberi awalan iso.
- Jika alkana memiliki cabang yang sama lebih dari satu, nama cabang digabung menjadi satu dan diberi awalan di-(jumlah cabang ada dua), tri-(jumlah cabang ada 3), tetra-(jumlah cabang ada empat).
- Jika alkana memiliki cabang yang berbeda, penulisan nama diurutkan berdasarkan urutan abjad.
Berikut contoh alkana rantai bercabang:

Sifat-Sifat Senyawa Alkana
Adapun sifat senyawa alkana yaitu:
a. Pada suhu kamar C1-C4 berwujud gas, C5-C17 berwujud cair dan di atas 17 berwujud padat
b. Semakin bertambah jumlah atom C maka Mr ikut bertambah akibatnya titik didih dan titik leleh semakin tinggi. Alkana rantai lurus memiliki titik didih lebih tinggi dibanding alkana rantai bercabang dengan jumlah atom C sama. Semakin banyak cabang, titik didih makin rendah.
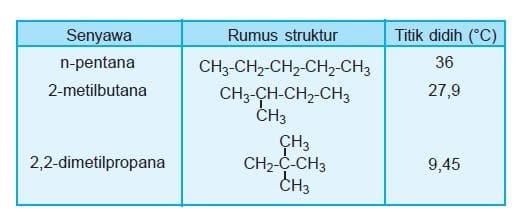
c. Alkana mudah larut dalam pelarut organik namun sukar latur dalam air
d. Oksidasi atau pembakaran alkana bersifat eksotermik atau menghasilkan kalor. Pembakaran alkana berlangsung sempurna dan tidak sempurna. Pembakaran sempurna menghasilkan gas CO2 sedang pembakaran tidak sempurna menghasilkan gas CO.
Reaksi pembakaran sempurna alkana, yaitu:
CH4(g) + 2 O2(g) ==> CO2(g) + 2 H2O(g) + E
Reaksi pembakaran tak sempurna alkana, yaitu:
2 CH4(g) + 3 O2(g)==> CO(g) + 4 H2O(g) + E
e. Alkana dapat bereaksi substitusi dengan halogen. Reaksi substitusi adalah reaksi penggantian atom/gugus atom dengan atom/gugus atom yang lain.
CH4(g) + Cl2(g) ==> CH3Cl(g) + HCl(g)
f. Senyawa alkana rantai panjang dapat mengalami reaksi eliminasi. Reaksi eliminasi adalah reaksi penghilangan atom/gugus atom untuk mendapatkan senyawa karbon lebih sederhana. Contoh pada reaksi eliminasi termal minyak bumi dan gas alam.
Kegunaan Alkana
Secara umum, alkana digunakan sebagai bahan bakar dan bahan baku dalam industri petrokimia.
- Metana, digunakan sebagai bahan bakar untuk memasak dan bahan baku pembuatan zat kimia seperti H2 dan NH3.
- Etana, digunakan sebagai bahan bakar untuk memasak dan sebagai refrigerant dalam sistem pendinginan dua tahap untuk suhu rendah.
- Propana, digunakan sebagai komponen utama gas elpiji untuk memasak dan bahan baku senyawa organik.
- Butana, digunakan sebagai bahan bakar kendaraan dan bahan baku karet sintetis
- Oktana, digunakan sebagai komponen utama bahan kendaraan bermotor , yakni bensin.
Demikian penjelasan yang bisa kami sampaikan tentang Pengertian Alkana, Tata Nama, Sifat, Kegunaan dan Contoh Alkana Terlengkap .Semoga bermanfaat dan sampai jumpa pada postingan selanjutnya.
Originally posted 2023-06-19 21:53:47.