Pernahkah Anda mengamati keadaan gua? Pada umumnya, keadaan di dalam gua adalah lembap, banyak tetesan air, stalaktit, dan stalakmit. Stalaktit dan stalakmit terbentuk dari endapan mineral kalsium karbonat (CaCO3). Endapan ini berasal dari penguraian senyawa Ca(HC03)2 yang membentuk reaksi kesetimbangan.
Ca(HC03)2(aq) CaC03(s) + CO2(g) + H20(ℓ)
Apakah yang dimaksud dengan reaksi kesetimbangan? Adakah faktor-faktor yang memengaruhi reaksi kesetimbangan? Untuk lebih jelasnya akan diuraikan penjelasan dibawah ini.
Reaksi Kimia
Reaksi kimia mudah kita jumpai di sekitar kita. Reaksi-reaksi tersebut ada yang berlangsung dengan sendirinya di alam, ada juga yang berlangsung karena sengaja dibuat oleh manusia. Berdasarkan sifat berlangsungnya reaksi, reaksi kimia dapat dibedakan menjadi dua yaitu reaksi searah dan reaksi dua arah.
a. Reaksi Searah/Tidak Dapat Balik/lrreversibel
Reaksi searah yaitu reaksi yang berlangsung dari arah reaktan ke produk atau ke kanan. Pada reaksi ini, produk tidak dapat bereaksi kembali menjadi zat-zat asalnya. Ciri-ciri reaksi searah yaitu:
- persamaan reaksi ditulis dengan satu anak panah ke arah produk/kanan (→)
- reaksi akan berhenti setelah salah satu atau semua reaktan habis;
- produk tidak dapat terurai menjadi zat-zat reaktan;
- reaksi berlangsung tuntas/berkesudahan.
Contoh reaksi searah:
NaOH(aq)+ HCI(aq) →NaCI (aq) + H2O(ℓ)
b. Reaksi Dua Arah/Dapat Balik/Reversibel
Reaksi dua arah yaitu reaksi yang dapat berlangsung dari reaktan ke produk atau ke kanan dan juga sebaliknya dari produk ke reaktan atau ke kiri. Ciri-ciri reaksi dua arah yaitu:
- persamaan reaksi ditulis dengan dua anak panah dengan arah berlawanan (⇔);
- reaksi ke arah produk disebut reaksi maju, reaksi ke arah reaktan disebut reaksi balik.
Contoh reaksi dua arah:
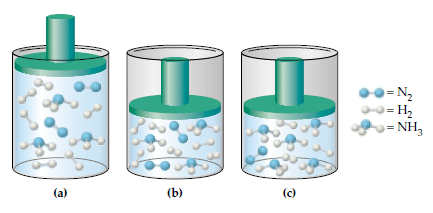
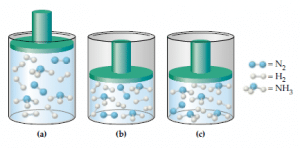
1. N2(g) + 3H2(g) ⇔ 2NH3(g)
2. H2O(ℓ) ⇔ H2O(g)
Pada reaksi reversibel dapat terjadi keadaan setimbang. Perhatikan reaksi berikut!
N2(g) + 3H2(g) ⇔ 2HN3(g)
Pada persamaan reaksi di atas terdapat dua laju reaksi, yaitu laju reaksi ke arah produk (NH3) dan laju reaksi ke arah reaktan (N2 + H2). Laju reaksi ke arah produk dipengaruhi oleh konsentrasi N2 dan H2, sedangkan laju reaksi ke arah reaktan dipengaruhi oleh konsentrasi NH3. Saat reaksi berlangsung, laju reaksi ke arah produk semakin lama semakin lambat seiring berkurangnya konsentrasi reaktan. Sebaliknya, laju reaksi ke arah reaktan semakin besar seiring bertambahnya konsentrasi produk. Pada suatu saat, laju reaksi ke arah produk sama dengan laju reaksi ke arah reaktan, jumlah setiap komponen tidak berubah, dan reaksi seolah-olah telah berhenti. Keadaan saat laju reaksi ke arah produk sama dengan laju reaksi ke arah reaktan disebut sebagai keadaan setimbang. Namun, perlu diingat bahwa keadaan setimbang hanya dapat berlangsung dalam sistem tertutup.
Kesetimbangan Kimia
Pada persamaan reaksi kesetimbangan kimia setiap terjadi reaksi ke kanan maka zat-zat produk akan bertambah, sementara zat-zat reaktan berkurang. Oleh karenanya, reaksi bergeser ke arah reaktan sehingga jumlah produk berkurang. Akibatnya, terjadi lagi reaksi ke arah kanan. Demikian ini terjadi terus-menerus, sehingga secara mikroskopis terjadi reaksi bolak-balik (dua arah) pada reaksi kesetimbangan. Keadaan seperti ini dikatakan bahwa kesetimbangan bersifat dinamis. Keadaan dinamis hanya terjadi dalam sistem tertutup.
Contoh kesetimbangan dinamis dalam kehidupan sehari-hari yaitu proses pemanasan air dalam wadah tertutup. Saat suhu mencapai 100°C air akan berubah menjadi uap dan tertahan oleh tutup. Apabila pemanasan dihentikan, uap air yang terbentuk akan berubah menjadi air kembali sehingga jumlah air di dalam wadah tidak akan habis. Reaksi yang terjadi adalah H2O(ℓ) ⇔ H2O(g). Reaksi ke kanan adalah reaksi penguapan sementara reaksi ke kiri adalah reaksi pengembunan. Kesetimbangan kimia mempunyai ciri-ciri sebagai berikut.
- Reaksi berlangsung dua arah dan dalam ruartg tertutup.
- Laju reaksi ke kiri dan ke kanan sama besar.
- Tidak terjadi perubahan makroskopis tetapi perubahan terjadi secara mikroskopis.
Berdasarkan wujud zat-zat dalam keadaan setimbang, kesetimbangan kimia dibedakan menjadi dua, yaitu kesetimbangan homogen dan heterogen.
Kesetimbangan Homogen
Kesetimbangan homogen yaitu kesetimbangan kimia yang di dalamnya terdapat satu macam wujud zat, misalnya gas atau larutan.
Contoh:
H2(g) + I2(g) ⇔ 2HI(g)
2SO2(g) +O2(g) ⇔ 2SO3(g)
Na+(aq) + CI–(aq) ⇔ NaCI(aq)
Kesetimbangan Heterogen
Kesetimbangan heterogen yaitu kesetimbangan kimia yang di dalamnya terdapat berbagai macam wujud zat, misalnya gas, padat, cair, dan larutan.
Contoh:
C(s) + H2O(g) ⇔ CO(g) + H2(g)
2CaHCO3(s) ⇔ Ca2C03(s) + H2O(ℓ) + C02(g)
HCO3-(aq) + H2O(ℓ) ⇔ CO2-3(aq) + H30+(aq)
Ag+(aq) + Fe2+(aq) ⇔ Ag(s) + Fe3+(aq)
Tetapan Kesetimbangan
Guldberg dan Waage mengemukakan hukum kesetimbangan dalam reaksi kesetimbangan kimia sebagai berikut.
”Dalam keadaan setimbang pada suhu tertentu, hasil kali konsentrasi hasil reaksi dibagi hasil kali konsentrasi pereaksi yang ada dalam sistem kesetimbangan yang masing-masing dipangkatkan dengan koefisiennya mempunyai harga tetap.” Hasil bagi tersebut dinamakan tetapan kesetimbangan dilambangkan dengan K.
Persamaan tetapan kesetimbangan berdasarkan konsentrasi (Kc) tergantung pada jenis reaksinya.
Reaksi Homogen Misal untuk reaksi:
2SO3(g) ⇔ 2SO2 (g) + O2(g)
Semua zat berada dalam wujud gas. Maka dari itu persamaan tetapan kesetimbangannya berasal dari masing-masing -zat. Persamaan tersebut disebut juga hukum Aksi Massa.
Reaksi Heterogen
Persamaan tetapan kesetimbangan pada reaksi heterogen dibedakan menjadi dua, yaitu reaksi heterogen yang melibatkan fase larutan dan gas.
- Persamaan tetapan kesetimbangan pada reaksi heterogen yang melibatkan fase cair, gas, dan padat, ditentukan oleh komponen-komponen yang berfase gas. Sementara fase cair dan padat tidak dihitung karena dianggap tetap.
Contoh:
2NaHC03(s) ⇔ Na2C03(s) + H20(ℓ) + CO2(g) - Persamaan tetapan kesetimbangan yang menyangkut fase padat dan gas, ditentukan oleh komponen-komponen yang berfase gas saja. Sementara fase padat dianggap tetap sehingga tidak dihitung.
Fe3O4(s) + 4CO (g) ⇔ 3fe (s) + aCO2(g)
Demikian penjelasan yang bisa kami sampaikan tentang Pengertian Reaksi Kimia, Kesetimbangan Kimia, dan Tetapan Kesetimbangan. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Baca postingan selanjutnya:
- Berbagai Cara Penentuan Perubahan Entalpi Reaksi
- Penjelasan Kemolaran Dan Pengertian Laju Reaksi Serta Persamaannya
- 8 Macam Perubahan Entalpi Dan Penjelasan Terlengkap
- Termokimia – Pengertian, Reaksi Termokimia dan Perubahan Entalpi
- Gaya Antarmolekul – Penjelasan Gaya Van Der Waals dan Ikatan Hydrogen
- Berbagai Bentuk Molekul, Pengertian Teori Domain Elektron Dan Teori Hibridisasi
Originally posted 2024-03-30 22:54:39.