Asam lemah banyak terdapat dalam buah-buahan seperti mangga, apel, dan jeruk. Asam lemah tidak berbahaya dan boleh dimakan. Basa lemah, seperti aluminium hidroksida (AI(OH)3) dapat ditemukan dalam obat mag. pH larutan asam lemah dan basa lemah dapat ditentukan jika diketahui tetapan kesetimbangannya. Beberapa hal yang berhubungan dengan asam lemah dan basa lemah sebagai berikut.

Derajat Ionisasi
Larutan dikelompokkan menjadi asamtcuat, asam lemah, basa kuat, dan basa lemah. Asam kuat mengalami ionisasi sempurna (α = 1) dan nilai pH rendah (konsentrasi molar ion H+ tinggi). Sementara itu, asam lemah terionisasi sebagian (0 < α < 1). Banyaknya zat yang mengalami ionisasi dinyatakan dengan derajat ionisasi. Derajat ionisasi (α) merupakan perbandingan antarajumlah zat yang terionisasi dengan jumlah zat yang dilarutkan.

Tetapan Kesetimbangan
Asam lemah mengalami ionisasi sebagian (a < 1) dan nilai pH sedang. Larutan asam lemah mengandung molekul-molekul asam, ion-ion H+, dan ion-ion sisa asam yang berada dalam kesetimbangan. Secara umum, ionisasi asam lemah valensi satu dirumuskan sebagai berikut.
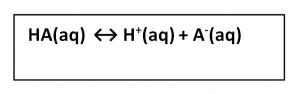
Tetapan kesetimbangan ionisasi asam lemah disebut tetapan ionisasi asam, dilambangkan dengan Ka. Ungkapan tetapan ionisasi untukasam lemah pada persamaan di atas sebagai berikut.
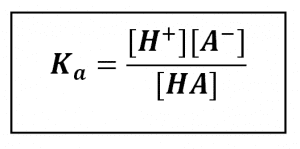
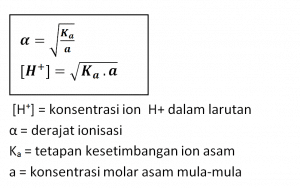
Harga Ka untuk asam lemah kecil. Semakin kecil harga a asam lemah, semakin kecil pula harga Ka- nya. Hubungan antara derajat ionisasi dengan tetapan kesetimbangan ionisasi asam lemah sebagai berikut.
Basa lemah mengalami ionisasi sebagian (α < 1). Larutan basa lemah mengandung molekul-molekul basa, ion-ion OH–, dan ion-ion logam yang berada dalam kesetimbangan. Reaksi ionisasi basa lemah, secara umum dirumuskan sebagai berikut.
LOH (aq)↔ L+(aq) + OH– (aq)
Tetapan kesetimbangan ionisasi basa lemah disebut tetapan ionisasi basa, dilambangkan dengan Kb. Ungkapan tetapan ionisasi untuk basa lemah pada persamaan di atas sebagai berikut.
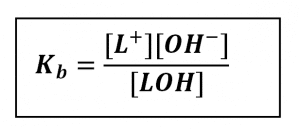
Harga Kb basa lemah kecil. Semakin kecil harga a basa lemah, semakin kecil harga Kb. Hubungan antara derajat ionisasi dengan tetapan kesetimbangan ionisasi basa lemah sebagai berikut.
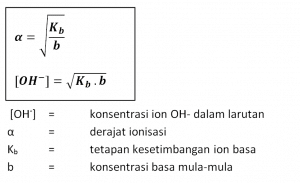
Harga pH larutan asam lemah atau basa lemah dapat dihitung jika derajat ionisasi atau Ka/Kb-nya diketahui.
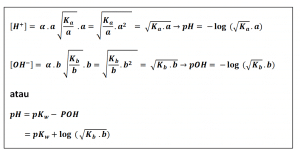
Asam lemah polivalen memiliki atom H lebih dari satu dalam molekulnya. Ionisasi asam lemah polivalen berlangsung bertingkat-tingkat. Tiap tingkatan ionisasi memiliki harga Ka yang berbeda-beda. Ionisasi tingkat pertama lebih mudah dari ionisasi tingkat kedua, dan seterusnya. Oleh sebab itu, harga Ka tingkat pertama lebih besar dari tingkat kedua, dan seterusnya. Harga pH asam lemah polivalen dihitung dengan menggunakan harga Ka yang paling besar.
Demikian penjelasan yang bisa kami sampaikan tentang Menghitung pH Larutan Asam Lemah dan Basa Lemah. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.





