Perubahan entalpi reaksi (ΔH) dapat ditentukan dengan berbagai cara, yaitu menggunakan kalorimeter, data entalpi pembentukan standar, diagram tingkat energi (hukum Hess), dan energi ikatan.Dibawah ini akan kita jelaskan secara rinci tentang penentuan perubahan entalpi reaksi.
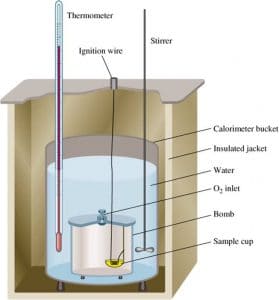
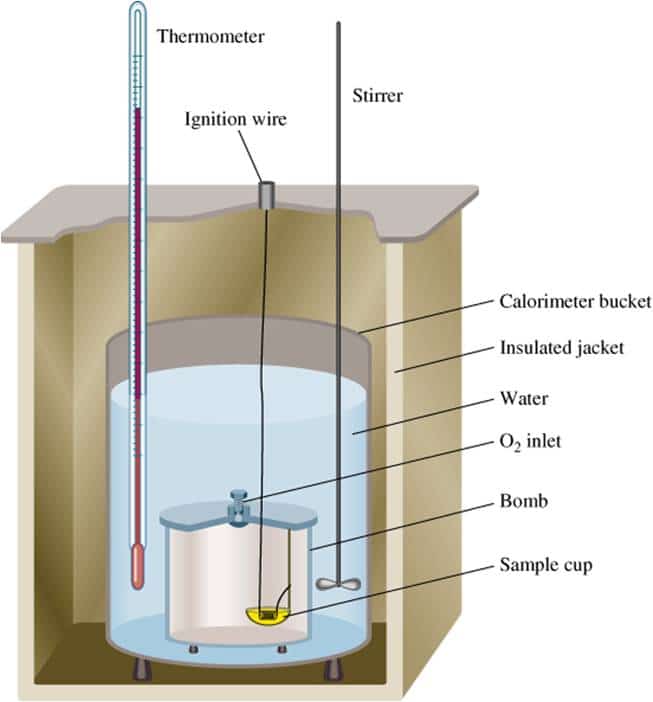
Penentuan ΔH Reaksi dengan Kalorimeter
Kalorimeter merupakan suatu sistem terisolasi sehingga tidak memungkinkan terjadinya pertukaran energi dan materi antara sistem dengan lingkungan. Oleh karena itu, kalorimeter dapat digunakan untuk menentukan jumlah kalor yang diserap oleh air dan perangkat kalorimeter. Semua kalor yang dilepaskan oleh sistem tidak ada yang terbuang ke lingkungan. Proses pengukuran kalor reaksi dengan kalorimeter dinamakan kalorimetri.
Rumus yang berlaku untuk menentukan besar (jumlah) kalor dalam kalorimeter:
q = m . C . AT Keterangan:
q = jumlah kalor (joule)
m = massa zat (g)
c = kalor jenis (Jg-1 °C-1)
ΔT = perubahan suhu (Takhir – Tawal)(°C)
Kalor jenis (c) merupakan jumlah kalor yang diperlukan untuk menaikkan 1 g zat sebesar 1 °C atau 1 K. Sementara itu, kapasitor panas (C) merupakan jumlah panas yang dibutuhkan untuk menaikkan suhu sebesar 1°C.
q = C • ΔT
ΔH = -q/mol
Keterangan:
q = jumlah kalor (joule)
C = kapasitas kalor (J°C_1)
ΔT = perubahan suhu (°C)
ΔH = perubahan entalpi
Penentuan ΔH Reaksi Berdasarkan Data Entalpi Pembentukan Standar (ΔH°f)
Penentuan harga perubahan entalpi reaksi (ΔHr) berdasarkan data entalpi pembentukan standar (ΔH°f) dihitung dengan cara menentukan selisih entalpi pembentukan standar (ΔH°f) antara produk dan reaktan, misal untuk reaksi berikut.

Penentuan ΔH Reaksi Berdasarkan Hukum Hess
Beberapa reaksi kimia ada yang berlangsung satu tahap ada yang berlangsung melalui beberapa tahap
dan tiap-tiap tahap memiliki sejumlah kalor tertentu.
Menurut Henry Hess, besarnya kalor reaksi (ΔH) suatu reaksi yang berlangsung beberapa tahap ditentukan sebagai berikut.
a. Apabila suatu reaksi dapat dinyatakan sebagai penjumlah aljabar, kalor reaksi juga merupakan penjumlah aljabar dari kalor yang menyertai reaksi-reaksi tersebut.
b. Kalor reaksi yang ditentukan/diserap tidak bergantung jalannya reaksi, tetapi bergantung pada kondisi zat-zat yang bereaksi dan zat-zat hasil reaksi.
Dengan demikian berlaku rumus hukum Hess:
∆H = ∆H1 + ∆H2 + ∆H3
Penentuan ΔH Reaksi Berdasarkan Energi Ikatan
Energi ikatan adalah energi yang diperlukan untuk memutuskan ikatan kimia dalam 1 mol suatu senyawa berwujud gas pada keadaan standar menjadi atom-atom penyusunnya. Berdasarkan jenis dan letak atom terhadap atom-atom lain dalam molekulnya, energi ikatan dibedakan menjadi tiga sebagai berikut.
a. Energi Atomisasi
Energi yang dibutuhkan untuk memutuskan semua ikatan dalam 1 mol molekul menjadi atom-atom bebas dalam keadaan gas.
b. Energi Disosiasi Ikatan
Energi yang dibutuhkan untuk memutuskan salah satu ikatan yang terdapat pada suatu molekul atau senyawa dalam keadaan gas.
c. Energi Ikatan Rata-Rata (D)
Energi rata-rata yang dibutuhkan untuk memutuskan ikatan atom-atom pada suatu senyawa.
Catatan: Suatu reaksi yang ditentukan ΔH-nya menggunakan energi ikatan, atom-atom yang terlibat dalam reaksi harus berwujud gas.
Demikian penjelasan yang bisa kami sampaikan tentang Berbagai Cara Penentuan Perubahan Entalpi Reaksi . Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Baca postingan selanjutnya:
- Penjelasan Kemolaran Dan Pengertian Laju Reaksi Serta Persamaannya
- 8 Macam Perubahan Entalpi Dan Penjelasan Terlengkap
- Termokimia – Pengertian, Reaksi Termokimia dan Perubahan Entalpi
- Gaya Antarmolekul – Penjelasan Gaya Van Der Waals dan Ikatan Hydrogen
- Berbagai Bentuk Molekul, Pengertian Teori Domain Elektron Dan Teori Hibridisasi