Pengertian, Jenis, Rumus dan Contoh Soal Hidrolisis Garam Beserta Jawaban Lengkap – Hidrolisis garam adalah penguraian garam oleh air atau reaksi ion-ion garam oleh air. Garam-garam yang mengalami hidrolisis ialah garam yang mengadung ion dari asam lemah, sedangkan garam yang berasal dari asam kuat atau basa kuat tidak bisa mengalami reaksi hidrolisis.
Hidrolisis garam dibedakan menjadi dua, yaitu diantaranya:
- Hidrolisis garam persial (sebagian)
Hidrolisis garam sebagian ialah reaksi garam dengan air dimana yang bisa bereaksi hanya anionnya saja atau kationnya saja. Garam yang mengalami hidrolisis sebagian, yaitu:
- Garam yang terbentuk dari asam lemah dan basa kuat.
- Garam yang berbentuk dari asam kuat dan basa lemah.
- Hidrolisis garam total
hidrolisis garam total ialah reaksi garam dengan air dimana semua ion garam dapat bereaksi dengan air, baik kation maupun anionnya. Garam yang mengalami hidrolisis total, yaitu garam yang berbentuk dari asam lemah dan basa lemah.
Macam-macam jenis garam yang dihasilkan dari reaksi asam dan basa, yaitu diantaranya:
Garam yang terbentuk dari asam lemah dan basa kuat
garam yang berasal dari asam lemah dan basa kuat dalam air mengalami hidrolisis sebagian. Komponen garam (anion asam lemah) mengalami hidrolisis menghasilkan ion OH-, jadi pH à 7 sehingga larutan garam bersifat basa. Misalkan CH3COOK, CH3COONa, KCN, CaS, dan lainnya.
Reaksi hidrolisis : K+(aq) + H2O(l) -/-> (tidak terhidrolisis)
CH3COO-(aq) + H2O(l) → CH3COOH(aq) + OH-(aq) bersifat basa.
Rumus :
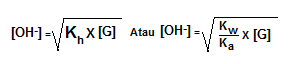
Keterangan :
Kh= konstanta hidrolisis
Kw= konstanta air
Ka=konstanta asam
h=derajat hidrolisis
[G]=konsentrasi garam
Untuk menentukan besarnya derajat hidrolisis garam yang berasal dari asam lemah dan basa kuat menggunakan rumus dibawah ini:
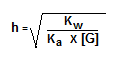
Contoh: apabila 50 mL larutan KOH 0,5 M dicampurkan dengan 50 mL CH#COOH 0,5 M, jadi hitunglah pH campuran yang terjadi (Ka = 10-6) !
Penyelesaian:
KOH + CH3COOK + H2O
M : 25 mmol 25 mmol 0 mmol 0 mmol
R : 25 mmol 25 mmol 25 mmol 25 mmol-
S : 0 mmol 0 mmol 25 mmol 25 mmol
pOH = – log 5 . 10-5 = 5 – log 5
pH = 14 – (5 – log 5) = 9 + log 5
Garam yang terbentuk dari asam kuat dan basa lemah
garam yang berasal dari asam kuat dan basa lemah dalam air mengalami hidrolisis sebagian dikarenakan salah satu komponen garam (kation basa lemah) mengalami hidrolisis menghasilkan ion H+ maka pH < 7 sehingga larutan garam bersifat asam. Contoh (NH4)2SO4, AgNO3, NH4CI, CuSO4 dan lainnya.
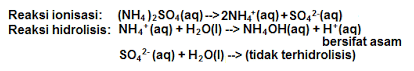
Rumus:
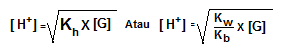
Keterangan:
Kh = konstanta hidrolisis
Kw = konstanta air
Kb = konstanta basa
h = derajat hidrolisis
[G] = konsentrasi garam
Untuk menentukan besarnya derajat hidrolisis garam yang berasal dari asam kuat dan basa lemah digunakan rumus:
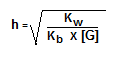
Contoh:
Diketahui 250 mL larutan (NH4)2SO4 0,1 M, Kb = 2 x 10-5. Tentukalah pH larutan tersebut!
Penyelesaian:
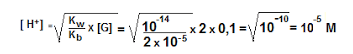
pH = – log 10-5 = 5
Jadi hasil larutan pH tersebut adalah 5.
Garam yang terbentuk dari asam lemah dan basa lemah
Garam yang berasal dari asam lemah dan basa lemah dalam air mengalami hidrolisis total, dikarenakan kedua komponen gara (anion asam lemah dan kation basa lemah) hidrolisis menghasilkan ion H+ dan ion OH-, sehingga harga pH larutan ini tergantung harga Ka dan Kb.
Contoh: NH4CN, (NH4)2S, CH3COONH4, dan lainnya.
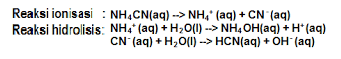
Rumus:
Keterangan:
Kw = konstanta air
Ka = konstanta asam
Kh = konstanta hidrolisis
Kb = konstanta basa
Harga pH dari garam yang terbentuk dari asam lemah dan basa lemah tergantung harga Ka dan Kb.
- Jika Ka = Kb, maka larutan akan bersifat netral (pH = 7)
- Jika Ka > Kb, maka larutan akan bersifat asam (pH < 7)
- Jika Ka < Kb, maka larutan akan bersifat basa (pH > 7)
Contoh:
Hitunglah pH larutan CH3COONH4 0,1 M. apabila di ketahui Ka CH3COOH = 10-10 !
Penyelesaian:
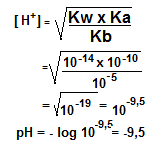
Garam yang terbentuknya dari asam kuat dan basa kuat
Garam yang berasal dari asam kuat dan basa kuat dalam air tidak mengalami hidrolisis, dikarenakan kedua komponen garam tidak terhidrolisis jadi pH larutan sama dengan air, yaitu pH = bersifat netral.
Contoh:
NaCI, Na2SO4, NaNO3, KCI, K2SO4, Ba(NO3)2, dan sebagaimana:
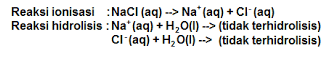
Demikian artikel tentang”Pengertian, Jenis, Rumus dan Contoh Soal Hidrolisis Garam Beserta Jawaban Lengkap“, semoga bermanfaat dan jangan lupa ikuti postingan kami berikutnya.
Originally posted 2023-05-08 04:52:07.