Kemampuan garam larut dalam air berbeda-beda. Natrium klorida (NaCI) termasuk salah satu contoh garam yang mudah larut dalam air. Apabila NaCI dilarutkan dalam air, mula-mula akan larut. Namun, jika semakin banyak NaCI yang ditambahkan ke dalam air, NaCI menjadi tidak larut karena terbentuk endapan. Kondisi ketika NaCI tidak dapat larut lagi dalam air disebut larutan jenuh.

Kelarutan (s)
Garam AgCI merupakan contoh garam yang sukar larut dalam air. Apabila dilarutkan dalam air, AgCI hanya sedikit larut. Akibatnya, sedikit saja AgCI ditambahkan dalam air, larutan telah menjadi jenuh. Dengan demikian, dapat disimpulkan bahwa zat yang mudah larut dalam air akan mengalami kejenuhan jika zat tersebut ditambahkan dalam jumlah besar. Sebaliknya, zat yang sukar larut dalam air akan menjadi jenuh dengan penambahan zat dalam jumlah kecil. Jumlah maksimum zat terlarut yang dapat larut dalam sejumlah pelarut disebut kelarutan (solubility). Misalnya, kelarutan AgCI = 1,25 x 10-5 mol/L, berarti jumlah maksimum AgCI yang dapat larut hanya 1,25 x 10-5 mol/L larutan. AgCI yang terlarut dalam air akan terurai menjadi ion-ionnya (ion Ag+ dan ion Cl-). Dengan demikian, garam-garam yang dapat larut akan mengalami ionisasi dan bersifat elektrolit. Dalam bentuk larutan jenuh, AgCI akan mengalami kesetimbangan reaksi ion sebagai berikut.
AgCI(s) ↔ Ag+(aq) + Cl–(aq)
Berdasarkan reaksi kesetimbangan di atas, jika kelarutan AgCI 1,25 x 10-5 mol/L, dalam larutan AgCI terdapat ion Ag+ sebanyak 1,25 x 10-5 mol/L dan ion Cl– sebanyak 1,25 x 10-5 mol/L. Selain bergantung pada jumlah zat yang dapat larut, kelarutan juga bergantung pada jenis zat pelarutnya.
Hasil Kali Kelarutan (Ksp)
Perkalian konsentrasi ion-ion elektrolit yang sukar larut dalam larutan jenuhnya dipangkatkan koefisiennya masing-masing disebut hasil kali kelarutan. Misalnya, larutan jenuh AxBy dalam air terjadi kesetimbangan sebagai berikut.
AxBy(s) ↔ xAy+(aq) + yBx-(aq)
Harga konstanta kesetimbangan (K) dari reaksi di atas sebagai berikut.
K[AxBy] = [Ay+][Bx-]y
Harga K[AxBy] sangat kecil karena merupakan senyawa ion yang sukar larut. Oleh karena itu, harga K[AxBy] dianggap tetap konstan sehingga disebut tetapan hasil kali kelarutan. Tetapan ini dinotasikan dengan Ksp (solubility product constant). Kesetimbangan di atas ditulis sebagai berikut.
Ksp = [Ay+][Bx-]y
Konsentrasi ion Ay+ dan Bx- dalam suatu larutan memengaruhi kejenuhan larutan.
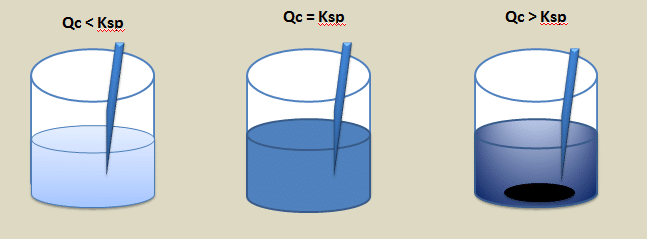
- Jika [Ay+]x [Bx-]y < Ksp AxBy, larutan belum jenuh.
- Jika [Ay+]x [Bx-]y = Ksp AxBy, larutan tepat jenuh atau mulai mengendap.
- Jika [Ay+]x [Bx-]y > Ksp AxBy, larutan lewat jenuh atau sudah mengendap.
Demikian penjelasan yang bisa kami sampaikan tentang Pengertian Kelarutan (k) Dan Hasil Kali Kelarutan (Ksp). Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Baca postingan selanjutnya:
- Hidrolisis Garam – Pengertian, Ciri-Ciri Dan Sifat Sifat Larutan Garam
- Fungsi Larutan Penyangga Dalam Tubuh Dan Kehidupan Sehari-hari
- Prinsip Kerja Larutan Penyangga Dan Sifat – Sifat Larutan Penyangga
- Pengertian Dan Macam – Macam Larutan Penyangga
- Pengertian Tritrasi,Stoikiometri Larutan Dan Grafik Titrasi Asam-Basa
- Peranan dan Pemanfaatan Asam Basa dalam Berbagai Bidang
- Menghitung pH Larutan Asam Lemah dan Basa Lemah
Originally posted 2024-04-02 14:56:20.