Pernahkah Anda melihat gelembung-gelembung ketika minuman bersoda dituangkan? Bagaimana bentuk dan jumlahnya? Gelembung-gelembung minuman bersoda merupakan inti molekul-molekul. Gelembung-gelembung minuman bersoda akan berjumlah banyak dan volumenya semakin membesar saat dituangkan. Hal ini dikarenakan adanya pengaruh tekanan dan jumlah mol dalam minuman tersebut. Fenomena ini merupakan contoh keseharian dari teori kinetik gas. Kita akan memperdalam pembahasannya pada artikel kali ini.

Persamaan Umum Gas
Hukum dari Persamaan Keadaan Gas Ideal
Gas ideal (sempurna) merupakan gas yang tenaga ikat antarmolekulnya dapat diabaikan. Kaidah- kaidah atau hukum-hukum yang menjelaskan tentang hal itu, dijelaskan sebagai berikut.
a. Hukum Boyle
Dalam sebuah sistem tertutup dan bersuhu konstan, besar tekanan gas akan berbanding terbalik dengan besarnya volume. Sistem dapat berupa ruangan, tabung, dan balon.
Rumus:
pV = konstan atau P1 V1 = p2 V2 = . . . = pN VN
b. Hukum Charles
Jika tekanan gas yang berada dalam bejana tertutup dijaga tetap, temperatur (suhu) mutlak gas sebanding dengan volumenya.
Rumus :
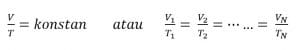
c. Hukum Gay-Lussac
Dalam sebuah sistem yang volume gas di dalamnya konstan (tetap), besarnya suhu mutlak gas sebanding dengan tekanannya.
Rumus:
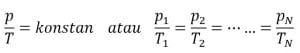
d. Persamaan Umum Gas Ideal
Penyatuan persamaan hukum Boyle, hukum Charles, dan hukum Gay-Lussac dikenal dengan persamaan umum gas ideal.
Rumus:
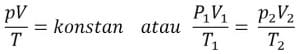
Persamaan Keadaan Gas Real
Persamaan keadaan gas Van der Waals: ”Jika gaya ikat antarmolekul tersebut diperhitungkan, diperlukan koreksi terhadap persamaan gas ideal”.
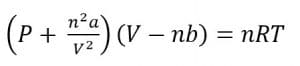
Penerapan Hukum-Hukum Gas Ideal pada Persoalan Fisika Sehari-hari
Berikut ini beberapa contoh penerapan hukum-hukum gas ideal dalam kehidupan sehari-hari.
a. Ban atau Balon Dapat Meletus di Bawah Terik Sinar Matahari
Sepeda yang diparkir saat matahari terik, gas di dalam ban akan mengalami kenaikan suhu. Jika suhu gas di dalam ban meningkat maka tekanan gas dalam ban juga akan naik. Lama-kelamaan J ban tersebut tidak dapat menahan tekanan gas sehingga ban meletus.
b. Gelembung pada Minuman Bersoda
Pada minuman bersoda yang dituang ke dalam gelas, akan tampak adanya gelembung- gelembung udara. Gelembung tersebut merupakan inti molekul-molekul C02. Ketika minuman dituangkan, temperatur relatif tetap. Namun, tekanan hidrostatis minuman bersoda saat dituang di dalam gelas sedikit berubah. Oleh karena itu, gelembung yang naik dari dasar permukaan minuman semakin besar.
c. Balon Udara Panas Dapat Mengudara
Balon udara bekerja berdasarkan pemuaian udara akibat pemanasan. Pemanasan pada balon dapat meningkatkan suhu udara dalam balon. Pemanasan tersebut juga menyebabkan volume dan tekanan gas berubah. Udara yang memuai menyebabkan massajenis udara dalam balon mengecil, nilainya lebih kecil dari massa jenis udara iuar, akjbatnya balon akan naik ke udara.
Rmus yang berlaku:
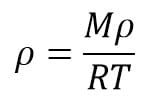
Contoh Soal !
1. Tentukan massa jenis gas 02 (M = 16 kg/kmol) pada suhu 27°C dan tekanan 2 atm!
Penyelesaian:
Diketahui:
Mo2 =16 kg/kmol
T 2 = 27 + 273 = 300 K
p =2 atm = 2 x 105 Pa
R =8.314 J/kmol K
Ditanyakan: r
Jawab:
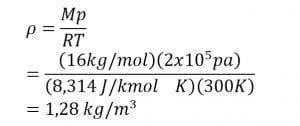
Jadi, massa jenis gas sebesar 1,28 kg/m2
2. Gas pada ruang tertutup mempunyai tekanan 2 atm dan volumenya 2 liter. Tentukan banyaknya partikel gas pada suhu 47°C!
Penyelesaian:
Diketahui :
P = 2 atm = a x 105 N/m2
V = 2 liter = 2 x 10-3 m3
T = 47 + 273 = 320 K
Ditanyakan : N
Jawab :
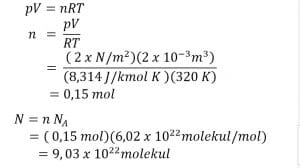
Jadi, banyaknya partikel gas pada suhu 47°C sebesar 9,03 x 1022 molekul.
3. Sebuah bejana berisi gas He yang memiliki volume 2 L, tekanan 1 atm dan suhunya 27`C. apabila suhunya dinaikkan menjadi 127`C dan ternyata tekanannya naik 2 kalinya. Hitunglah volumenya!
Cara Penyelesaian:
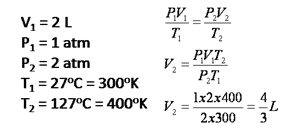
Terdapat sebuah tangki bervolume 3000 cm3 berisi gas O2 pada suhu 20`C dan tekanan relatif pada alat 25 atm. apabila massa molar O2=32 kg/kmol, tekanan udara luar 1 atm, jadi berapakah massa O2 yang ada di dalam tangki tersebut ?
Cara penyelesaian:

Demikian penjelasan yang bisa kami sampaikan tentang Teori Kinetik Gas – Persamaan Umum Gas, Hukum Gas Ideal Dan Pembahasan Contoh Soal. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Baca postingan selanjutnya:
- Fluida Dinamis – Penjelasan Jenis Aliran Fluida Dinamis Dan Pembahasan Contoh Soal
- Fluida Statis – Pengertian , Penerapan Hukum Dasar Fluida Statis Dan Contoh Soal
- Syarat Dan Posisi Titik Berat Kesetimbangan Benda Tegar Dan Pembahasan Soal
- Dinamika Gerak Rotasi : Pengertian, Rumus Dan Pembahasan Contoh Soal
- Teorema Usaha Dan Energi – Pengertian Dan Rumus Usaha, Energi, Dan Daya
- Gerak Harmonik, Pengertian, Rumus Dan Bentuk Gerak Harmonik Sederhana