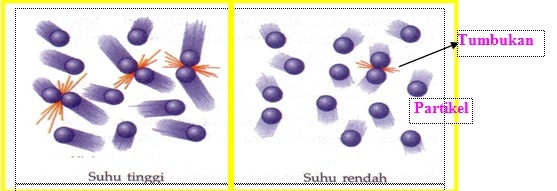
Reaksi kimia terjadi ketika partikel-partikel zat yang bereaksi (pereaksi) saling bertumbukan. Namun, tidak semua tumbukan yang terjadi akan menghasilkan zat baru. Zat baru dapat dihasilkan dari tumbukan yang berlangsung sempurna. Tumbukan sempurna dinamakan tumbukan efektif. Partikel zat yang saling bertumbukan kadang-kadang juga tidak langsung berubah menjadi zat hasil. Tumbukan tersebut terlebih dahulu membentuk suatu molekul kompleks yang disebut molekul kompleks teraktivasi. Pembentukan molekul kompleks teraktivasi berhubungan dengan energi aktivasi. Energi aktivasi (EA) merupakan energi tumbukan terendah yang diperlukan untuk pembentukan molekul kompleks teraktivasi sehingga reaksi dapat berlangsung.
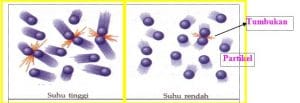
Tumbukan yang menghasilkan reaksi adalah tumbukan yang antar partikelnya mempunyai energi lebih besar daripada energi aktivasi. Semakin kecil harga energi aktivasi, semakin cepat reaksi berlangsung.
Reaksi P + Q → R + S dapat terjadi jika P + Q memiliki energi aktivasi minimum. Adanya energi aktivasi minimum memungkinkan terjadinya tumbukan yang menghasilkan energi, dengan syarat energi tumbukan pereaksi > Ea.
Teori tumbukan
Teori tumbukan yang didasarkan atas teori kinetik molekul gas menyatakan beberapa hal berikut.
- Gas terdiri atas molekul-molekul gas yang berukuran lebih kecil daripada jarak antarmolekul.
- Molekul-molekul gas selalu bergerak lurus ke segala arah.
- Tumbukan antara molekul-molekul gas dengan dinding wadahnya bersifat elastis sempurna, artinya molekul-molekul gas akan dipantulkan kembali tanpa kehilangan energi.
- Kecepatan gerak molekul gas dipengaruhi oleh perubahan suhu. Semakin tinggi suhu, maka semakin cepat gerak molekul-molekul gas.
- Energi kinetik rata-rata molekul gas sama besar pada suhu yang sama atau tidak dipengaruhi oleh massanya.
Besarnya laju reaksi dari suatu reaksi kimia dipengaruhi oleh beberapa faktor. Kita dapat mengatur besarnya laju reaksi dengan cara mengubah faktor-faktor yang memengaruhi laju reaksi. Namun, perlu diingat bahwa untuk data sebuah percobaan dengan variasi beberapa faktor, tidak semua faktor selalu berpengaruh.
Faktor-Faktor yang Memengaruhi Laju Reaksi
a. Konsentrasi
Konsentrasi berhubungan dengan frekuensi tumbukan. Semakin besar konsentrasi, maka semakin banyak partikel zatyang bereaksi. Akibatnya, kemungkinan tumbukan antarpartikel pereaksi semakin besar dan tumbukan efektif antarpartikel juga semakin banyak. Dengan demikian, reaksi akan semakin cepat berlangsung.
b. Luas Permukaan
Jika luas permukaan semakin besar, kemungkinan terjadi singgungan antarpereaksi juga akan semakin besar. Hal ini akan memperbanyak frekuensi tumbukan sehingga tumbukan efektif juga akan banyak terjadi. Frekuensi tumbukan efektif yang semakin banyak akan meningkatkan laju reaksi.
c. Suhu
Ketika suhu dinaikkan, energi kinetik dalam molekul reaktan juga bertambah. Adanya energi kinetik yang tinggi mengakibatkan gerakan antarmolekul semakin cepat dan acak. Akibatnya, frekuensi tumbukan yang terjadi semakin besar, dan tumbukan efektif juga akan semakin banyak sehingga reaksi semakin cepat berlangsung.
d. Katalis
Katalis yaitu zat yang dapat mempercepat laju reaksi tanpa mengalami perubahan kimia secara kekal atau permanen sehingga pada akhir reaksi zat tersebut dapat diperoleh kembali. Katalis dibedakan menjadi dua, yaitu katalis homogen dan katalis heterogen.
Katalis homogen yaitu katalis yang mempunyai fase sama dengan fase pereaksi. sedangkan, Katalis heterogen yaitu katalis yang mempunyai fase berbeda dengan fase pereaksi. Pada umumnya katalis heterogen digunakan dalam wujud padat. Sementara itu, reaktannya berwujud gas.
Penambahan katalis mengakibatkan terbentuknya tahap-tahap reaksi tambahan yang memberikan jalan lain dengan energi aktivasi (Ea) lebih rendah. Energi aktivasi (Ea) yaitu energi minimal yang harus dimiliki atau diberikan kepada partikel agartumbukannya menghasilkan reaksi. Tahap-tahap reaksi tambahan berupa tahap pengikatan katalis dan tahap pelepasan katalis pada akhir reaksi. Katalis bersifat spesifik, yaitu hanya dapat berfungsi untuk suatu reaksi tertentu.
Katalis berfungsi untuk menurunkan energi aktivasi. Adanya katalis akan mengakibatkan reaksi berlangsung dalam beberapa tahap. Rangkaian tahap-tahap reaksi dalam suatu reaksi kimia disebut mekanisme reaksi. Tahap reaksi paling lambat dalam suatu mekanisme reaksi merupakan tahap penentu laju reaksi.
Demikian penjelasan yang bisa kami sampaikan tentang Pengertian Teori Tumbukan dan Faktor-Faktor yang Mempengaruhi Laju Reaksi. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Baca postingan selanjutnya:
- Berbagai Cara Penentuan Perubahan Entalpi Reaksi
- Penjelasan Kemolaran Dan Pengertian Laju Reaksi Serta Persamaannya
- 8 Macam Perubahan Entalpi Dan Penjelasan Terlengkap
- Termokimia – Pengertian, Reaksi Termokimia dan Perubahan Entalpi
- Gaya Antarmolekul – Penjelasan Gaya Van Der Waals dan Ikatan Hydrogen
- Berbagai Bentuk Molekul, Pengertian Teori Domain Elektron Dan Teori Hibridisasi