Setiap reaksi yang berlangsung selalu melibatkan komponen-komponen berupa pereaksi, hasil reaksi, dan laju reaksi. Rada saat reaksi berlangsung, konsentrasi zat pereaksi dan zat hasil reaksi akan mengalami perubahan. Reaksi ada yang berlangsung cepat tetapi ada juga yang berlangsung lambat. Cepat lambatnya reaksi dipengaruhi oleh banyak faktor, di antaranya konsentrasi zat-zat yang bereaksi. Konsentrasi zat yang terlibat dalam reaksi ini menggunakan satuan molaritas (M).

Kemolaran (M)
Kemolaran atau molaritas yaitu banyaknya mol zat terlarut dalam satu liter larutan. Perumusan molaritas sebagai berikut.
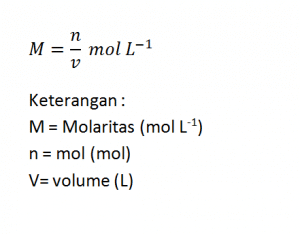
Larutan dengan molaritas tertentu dapat dibuat dari padatan murni atau larutan pekatnya. Membuat larutan dari padatan murni dilakukan dengan melarutkan padatan murni dengan jumlah tertentu ke dalam satu liter pelarut. Misal, akan membuat 1 liter larutan NaOH 0,1 M dari kristal NaOH. Langkah- langkah yang harus dilakukan sebagai berikut.
- Menyiapkan alat dan bahan yang digunakan yaitu kristal NaOH, labu ukur 1 L, akuades, neraca, pipet foks, dan sendok stainless steel.
- Menghitung massa NaOH yang diperlukan dari konsentrasi yang diinginkan.
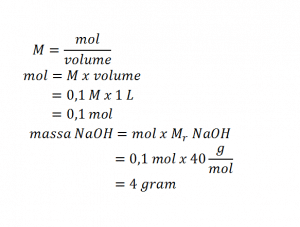
- Menimbang 4 gram kristal NaOH.
- Mengisi labu ukur dengan akuades, sebanyak volume yang diinginkan.
- Melarutkan kristal NaOH ke dalam akuades dalam labu, tambahkan air hingga batas tanda 1 L, kocok hingga kristal NaOH larut sempurna.
Sementara itu, untuk membuat larutan dengan konsentrasi tertentu dari larutan pekatnya dapat dilakukan dengan cara pengenceran menggunakan rumus berikut.

Jika diketahui kadar dan massa jenisnya, penentuan molaritas menggunakan rumus berikut ini:

Sememntara itu, untuk molarits campuran larutan dapat dihitung menggunakan rumus berikut:

Pengertian Laju Reaksi (v)
Laju reaksi menyatakan ukuran seberapa cepat atau lambat suatu reaksi berlangsung. Jika ditinjau dari waktu berlangsungnya reaksi, reaksi kimia ada yang berlangsung cepat dan ada yang berlangsung lambat.
Pembakaran kembang api merupakan contoh reaksi yang berlangsung cepat. Sementara itu, proses pematangan buah memerlukan waktu yang lama sehingga reaksi kimia tersebut termasuk reaksi yang berlangsung lambat.
Laju reaksi didefinisikan sebagai perubahan konsentrasi reaktan atau produk setiap satuan waktu. Laju reaksi dirumuskan sebagai berikut.

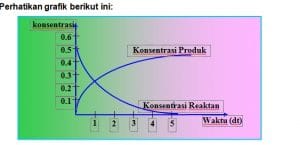
Grafik konsentrasi pereaksi dan konsentrasi produk terhadap waktu sebagai berikut:
Jika diketahui persamaasn reaksi:
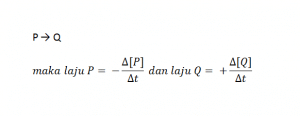
Δ[P] dan Δ[Q] merupakan konsentrasi dalam satuan molar pada periode waktu Δt. Δ[P] diberi tanda negatif karena konsentrasi P berkurang. Sebaliknya,Δ[Q] diberi tanda positif karena konsentrasi Q bertambah. Secara umum laju reaksi dirumuskan sebagai berikut.

Pada reaksi yang lebih kompieks, diperlukan kehati-hatian dalam menuliskan persamaan laju reaksinya. Misal, untuk reaksi 2A → B. Pada reaksi tersebut, dua mol A diperlukan untuk menghasilkan satu mol B. Ini berarti bahwa laju berkurangnya A dua kali lebih cepatdari laju pembentukan B. Dengan demikian, laju reaksinya dituliskan sebagai berikut.

Catatan:
Tanda positif menunjukkan penambahan jumlah produk, sedangkan tanda negatif menunjukkan pengurangan jumlah reaktan.
Persamaan Laju Reaksi dan Orde Reaksi
Gulberg dan Waage merumuskan hubungan kuantitatif antara konsentrasi zat-zat yang bereaksi dengan laju reaksi dalam hukum Aksi Massa sebagai berikut.
’’Laju reaksi dalam suatu sistem homogen pada suatu temperatur berbanding lurus dengan konsentrasi zat yang bereaksi, setelah masing-masing konsentrasi dipangkatkan dengan koefisiennya dalam persamaan reaksi yang bersangkutan”.

Tetapan jenis reaksi (k) merupakan suatu tetapan yang harganya bergantung pada suhu dan zat pereaksi. Dengan demikian, setiap reaksi mempunyai harga k yang berbeda-beda. Pada umumnya, reaksti yang berlangsung lambat mempunyai harga k kecil, sedangkan reaksi yang berlangsung cepat, mempunyai harga k besar.
Tingkat reaksi atau orde reaksi yaitu pangkat konsentrasi zat dalam rumus laju reaksi. Secara teoritis, tingkat reaksi pada reaksi kimia merupakan jumlah koefisien zat-zat yang bereaksi dalam persamaan reaksinya.
Rumus laju reaksi sebenarnya hanya dapat ditentukan secara eksperimen. Caranya dengan melakukan percobaan secara berulang-ulang terhadap zat yang akan ditentukan laju reaksinya. Pada percobaan ini, konsentrasi diubah-ubah dan waktu berlangsungnya reaksi dihitung.
Beberapa variabel yang digunakan dalam menentukan laju reaksi dengan cara eksperimen sebagai berikut.
- Variabel Bebas (Variabel Manipulasi)
Variabel bebas yaitu variabel yang sengaja diubah-ubah untuk memperoleh hubungan satu besaran dengan besaran lain. Misal konsentrasi dan suhu. - Variabel Kontrol
Variabel kontrol yaitu variabel yang dipertahankan atau tidak diubah-ubah. - Variabel Terikat (Variabel Respon)
Variabel terikat yaitu variabel yang berubah karena adanya perubahan variabel bebas. Misalnya laju reaksi yang berubah karena konsentrasi diubah.
Demikian penjelasan yang bisa kami sampaikan tentang Penjelasan Kemolaran Dan Pengertian Laju Reaksi Serta Persamaannya. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Baca postingan selanjutnya:
- 8 Macam Perubahan Entalpi Dan Penjelasan Terlengkap
- Termokimia – Pengertian, Reaksi Termokimia dan Perubahan Entalpi
- Gaya Antarmolekul – Penjelasan Gaya Van Der Waals dan Ikatan Hydrogen
- Berbagai Bentuk Molekul, Pengertian Teori Domain Elektron Dan Teori Hibridisasi
- Mempelajari Sejarah Perkembangan Ilmu Kimia Terlengkap
- Hubungan Ilmu Kimia Dengan Ilmu Pengetahuan Lainnya