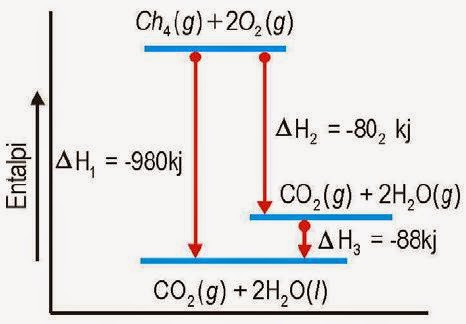
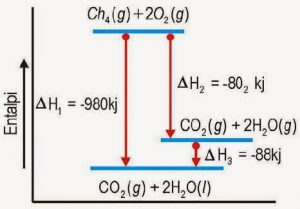
Postingan sebelumnya admin telah membahas tuntas tentang Termokimia – Pengertian, Reaksi Termokimia dan Perubahan Entalpi. Kali ini akan membahas macam-macam perubahan entalpi secara lengkap dengan penjelasannya.
Perubahan entalpi yang menyertai suatu reaksi selalu dipengaruhi oleh suhu dan tekanan. Apabila suhu zat semakin tinggi, perubahan entalpinya semakin besar. Data termokimia pada umumnya ditetapkan pada tekanan 1 atm dan suhu 25°C. Kondisi ini dikenal sebagai kondisi standar. Oleh karena itu, penentuan perubahan entalpi (ΔH) juga ditukar pada kondisi standar dan dikenal dengan perubahan entalpi standar. Berdasarkan jenis reaksinya, perubahan entalpi standar dapat dibedakan sebagai berikut.
1. Perubahan Entalpi Pembentukan Standar (ΔH°f)
Perubahan entalpi pembentukan standar (ΔH°f) yaitu perubahan entalpi yang diperlukan atau dilepaskan pada pembentukan 1 mol senyawa dari unsur-unsurnya pada suhu dan keadaan standar. Jika tidak diukur pada keadaan standar, perubahan entalpi pembentukan dinotasikan ΔH°f. Perubahan entalpi pembentukan disebut juga kalor pembentukan.
Contoh:
Entalpi pembentukan standar natrium klorida membebaskan kalor sebesar 401,9 kJ/mol. Persamaan termokimianya sebagai berikut.
Na(s) + ½ (g) → NaCI(s) ΔH = -401,9 kJ/mol
2. Perubahan Entalpi Penguraian Standar (ΔH°d)
Perubahan entalpi penguraian standar yaitu perubahan entalpi yang diperlukan atau dilepaskan pada penguraian 1 mol senyawa menjadi unsur-unsurnya pada keadaan standar. Hukum Laplace menyatakan bahwa jumlah kalor yang dilepaskan pada pembentukan senyawa dari unsur-unsurnya sama dengan jumlah kalor yang diperlukan pada penguraian senyawa tersebut menjadi unsur-unsurnya. Contoh:
Jika ΔH°f H2O(g) = -285,85 kJ/mol maka ΔH°d H2O (g) = +285,85 kJ/mol.
3. Perubahan Entalpi Pembakaran Standar (ΔH°C)
Perubahan entalpi pembakaran standar yaitu perubahan entalpi yang diperlukan dan dilepaskan pada pembakaran sempurna 1 mol zat pada keadaan standar.
Contoh:
Pembakaran 1 mol etanoi, membebaskan kalor 1.350 kJ/mol
C2H5OH(ℓ) + 302(g) -> 2CO2(g) + 3H20(g) ΔH = -1.350 kJ/mol
4. Perubahan Entalpi Netralisasi Standar (ΔH°n)
Perubahan entalpi netralisasi standar yaitu perubahan entalpi yang diperlukan atau dilepaskan untuk menetralkan 1 mol asam oleh basa atau 1 mol basa oleh asam yang diukur pada keadaan standar.
Contoh:
2NaOH(aq) + H2S04(aq) -> Na2S04(aq)+ 2H20(ℓ)
ΔH reaksi = -200 kJ _kj
ΔH°n NaOH = -200/2mol kJ/mol
H°n H2S04 = -200 kJ
5. Perubahan Entalpi Penguapan Standar (ΔH°vap)
Perubahan entalpi penguapan standar yaitu perubahan entalpi yang diperlukan atau dilepaskan pada saat 1 mol zat dalam fase cair berubah menjadi fase gas pada keadaan standar.
Contoh:
H2O(t) -> H2O(g) ΔH°vap = + 44 kJ
6. Perubahan Entalpi Peleburan Standar (ΔH°fus)
Perubahan entalpi peleburan standart yaitu perubahan entalpi yang diperlukan atau dilepaskan pada saat 1 mol zat fase padat berubah menjadi fase cair pada keadaan standart.
Contoh: H2O(s) -> H2O(ℓ) ΔH°fus =+6,01 kj
7. Perubahan Entalpi Sublimasi Standar (AH°sub)
Perubahan entalpi sublimasi standar yaitu perubahan entalpi yang diperlukan atau dilepaskan pada saat 1 mol zat fase padat berubah menjadi fase gas pada keadaan standar.
Contoh:
H2O(S) -> H2O(g) ΔH°sub = +50,01 kJ
AH°sub = ΔH°fus + ΔH°vap
8. Perubahan Entalpi Pelarutan Standar (ΔH°sol)
Perubahan entalpi pelarutan standar yaitu perubahan entalpi yang diperlukan atau dilepaskan ketika 1 mol zat melarut dalam suatu pelarut pada keadaan standar.
Contoh:
HCI(g) -> HC(aq) ΔH°s0l = -75,14kJ
Demikian penjelasan yang bisa kami sampaikan tentang 8 Macam Perubahan Entalpi Dan Penjelasan Terlengkap. Semoga postingan ini bermanfaat bagi pembaca dan bisa dijadikan sumber literatur untuk mengerjakan tugas. Sampai jumpa pada postingan selanjutnya.
Baca postingan selanjutnya:
- Termokimia – Pengertian, Reaksi Termokimia dan Perubahan Entalpi
- Gaya Antarmolekul – Penjelasan Gaya Van Der Waals dan Ikatan Hydrogen
- Berbagai Bentuk Molekul, Pengertian Teori Domain Elektron Dan Teori Hibridisasi
- Mempelajari Sejarah Perkembangan Ilmu Kimia Terlengkap
- Hubungan Ilmu Kimia Dengan Ilmu Pengetahuan Lainnya
- Manfaat / Peranan Ilmu Kimia Dalam Kehidupan Dan IPTEK
- Penjelasan Ruang Lingkup Ilmu Kimia Terlengkap